新的研究发现,细胞摄取物质的方式比以前想象的要精确得多,这为几种疾病的潜在治疗打开了大门。3月28日在NatureStructuralandMolecularBiology上发表的“为货物内化启动AP2网格蛋白适配器的内吞检查点的结构基础”揭示了内吞作用——外部分子的摄入。
人体内的每个细胞都依赖内吞作用来生存。然而,细胞如何为这个摄入过程收集外部货物还没有得到很好的理解。
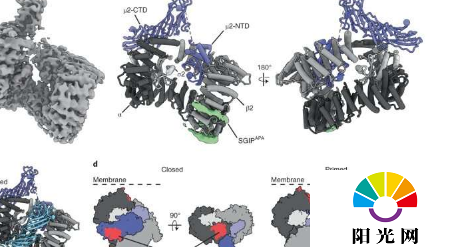
为了准确地观察细胞膜上发生的情况,博士生EdwardPartlow和分子医学系助理教授GuntherHollopeter与北卡罗来纳大学医学院的KevinCannon和RichardBaker合作,他们专门研究低温电子显微镜(cryo-EM),一种使用电子在分子尺度上捕捉事物图像的技术。
此前,Hollopeter小组揭示了一种内吞作用的分子机制:一种称为muniscin的蛋白质与另一种称为AP2的蛋白质结合,然后充当另一种蛋白质的开关,然后指定货物将被内化的位置。打开后,AP2被吸入称为囊泡的气泡状隔间,并将货物带入细胞。
然而,Partlow和Hollopeter意识到他们的假设是不完整的。Muniscins不跟随AP2进入囊泡。“这意味着AP2必须以某种方式在没有muniscin的情况下保持‘开启’,”Partlow说。此外,他最初的生化实验表明,与muniscin结合的AP2实际上并未处于“开启”状态。“此时,我们只知道AP2处于某种新状态,”Partlow说,“但不知道那个状态是什么。”
他们使用冷冻电镜发现的结果让他们所有人都感到惊讶:Municins在AP2中诱导了一种前所未有的状态——介于关闭和开启之间的状态——一种“启动”状态。当Partlow向系统添加货物时,AP2放弃了muniscin并采用了完全“开启”状态。“这种新的AP2启动状态似乎充当了检查点,以确保仅允许货物结合的复合物进入囊泡,”Hollopeter说。
Partlow使用了人们来剧院看演出的类比。“muniscin就像剧院工作人员,检查顾客或AP2是否有‘票’——即货物,”他说。“muniscin绑定没有票的AP2,阻止AP2进入‘剧院’或囊泡,但一旦AP2拿到票,它就可以进入。”
一旦货物与AP2结合,粘连蛋白就会分离并准备重新开始,招募新的AP2蛋白为新的细胞外货物做准备。
这一发现颠覆了一个长期存在的假设,即细胞只调节胞吐作用,即内部货物的释放,但内吞作用在僵尸般的自动驾驶仪上运行。“引发AP2的发现令人兴奋,因为这意味着内吞作用也有控制杆,”Hollopeter说。这些杠杆帮助细胞确保高优先级货物快速有效地内化。
研究人员希望深入研究在细胞中引发的后果,以及其他蛋白质如何与引发的AP2相互作用。随着他们继续这项基础工作,它可能会导致针对内吞作用被劫持的疾病的新疗法,包括癌症、高胆固醇和病毒性疾病。
“我们希望这个新发现的检查点可以用于治疗这些疾病,”Partlow说。