由于其在传感,药物输送和可切换存储系统中的应用,刺激响应性超分子结构已经成为传统结构的替代物。现在,东京工业大学的科学家探索了“折叠器”(模仿蛋白质折叠的人工分子)的静水压力响应,并报告了随着压力变化其首选构型的变化,证明了具有静水压力的动态控制能力。这一发现为压敏性折叠剂和人造材料的未来发展打开了大门。
大多数(如果不是全部)生物系统极其复杂,通常依赖于传统化学未关注的相互作用。基于依赖人工分子机器模拟生物学功能的方法,启发了整个研究领域,即超分子化学,以精确地研究那些控制生物学过程的相互作用。这些分子机器对广泛的外部刺激(例如温度,周围介质,光激发)做出响应,因此在传感,药物输送,分子成像和可切换存储技术中得到了应用。
但是,长期以来一直采用一种特殊的刺激方法,即静水压力,这是因为它具有显着的事实,即可以在不受干扰和受压的状态下研究超分子材料。实际上,总部设在的一个由东京工业大学(东京理工大学)的科学家组成的研究小组最近表明,超分子材料溶液中的光学性质和化学过程可以通过静水压力精确地调节。
受他们的发现启发,由东京工业大学的Fakuhara教授和立命馆大学的前田博光教授带领的研究小组继续研究压力对“折叠器”(模拟蛋白质的人工分子)的影响。他们的发现发表在《化学科学》杂志上。foldamer之所以得名,是因为这些系统可以将折叠的蛋白质复制为明确定义的模式。Fukuhara Gaku教授解释了他们进行这项研究的动机:“尚未详细研究在静水压力下折叠剂的溶液状态行为,这对超分子化学的进一步发展提出了挑战。”
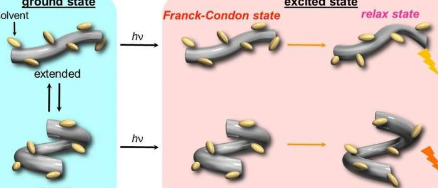
为了使折叠剂折叠成特定的构象,它首先需要结合到客体带负电荷的离子上,该离子形成螺旋结构的外消旋状态(相等数量)。然后可以通过引入不对称抗衡正离子(一种称为离子对的过程)来诱导所得结构的手性(或不同于其镜像的性质)。但是,离子对取决于折叠剂的溶剂化条件,而溶剂化条件又会受到静水压力的影响。因此,科学家选择了荧光折叠剂作为负离子受体(称为主体),并选择了手性离子对(例如氯离子和溴离子)作为客体,以研究在静水压力下宿主溶液的光学性质。
科学家们首先研究了在压力下各种有机溶剂中宿主的荧光和吸收(在紫外线和可见光下)光谱的变化,并观察到光谱带向更长波长的逐渐移动以及随着压力升高吸收度的增加。他们认为这是由于宿主最初采用了两个构象异构体,一个是延伸的,一个是折叠的,并在加压时逐渐转变为延伸-富集的状态。然后,在电子激发(hυ)之后,从这些构象异构体观察到两个不同的荧光状态。
福原教授兴奋地评论说:“我们的研究清楚地表明,只需改变静水压力,就可以在基态和激发态下动态地控制柔性折叠主体的构象。” 他补充说:“实际上,这种策略甚至可以扩展到彼此难以感应或不显示客体化学性质的其他折叠和客体组合。”
该团队在更好地解读折叠蛋白方面所做的努力无疑使我们更进一步地理解了蛋白质的复杂性。